5 lipca firma Novo Nordisk rozpoczęła w Chinach badanie kliniczne III fazy preparatu CagriSema zastrzyk, którego celem jest porównanie bezpieczeństwa i skuteczności zastrzyku CagriSema z semeglutydem u pacjentów z otyłością i nadwagą w Chinach.
Zastrzyk CagriSema to długo działająca terapia skojarzona opracowywana przez firmę Novo Nordisk, której głównymi składnikami są smeglutyd, agonista receptora GLP-1 (peptyd glukagonopodobny-1) i długo działający analog amyliny, kagrilintyd.Zastrzyk CagriSema można podawać podskórnie raz w tygodniu.
Głównym celem było porównanie leku CagriSema (2,4 mg/2,4 mg) z semeglutydem lub placebo podawanymi podskórnie raz w tygodniu.Firma Novo Nordisk ogłosiła wyniki badania preparatu CagriSema w leczeniu cukrzycy 2. stopnia, które wykazało, że działanie hipoglikemiczne preparatu CagriSema jest lepsze niż semeglutydu, a prawie 90% pacjentów osiągnęło docelowy poziom HbA1c.
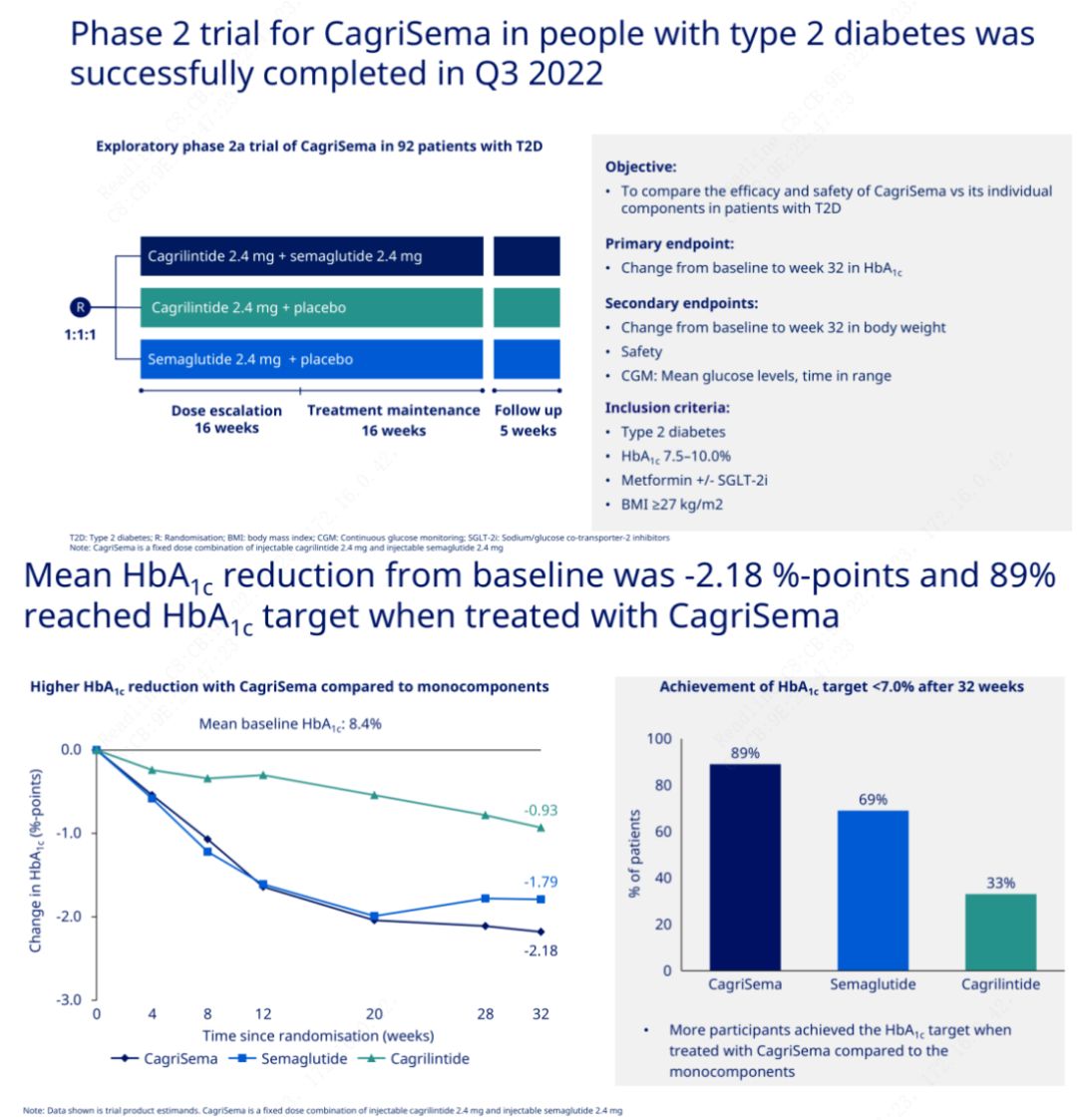
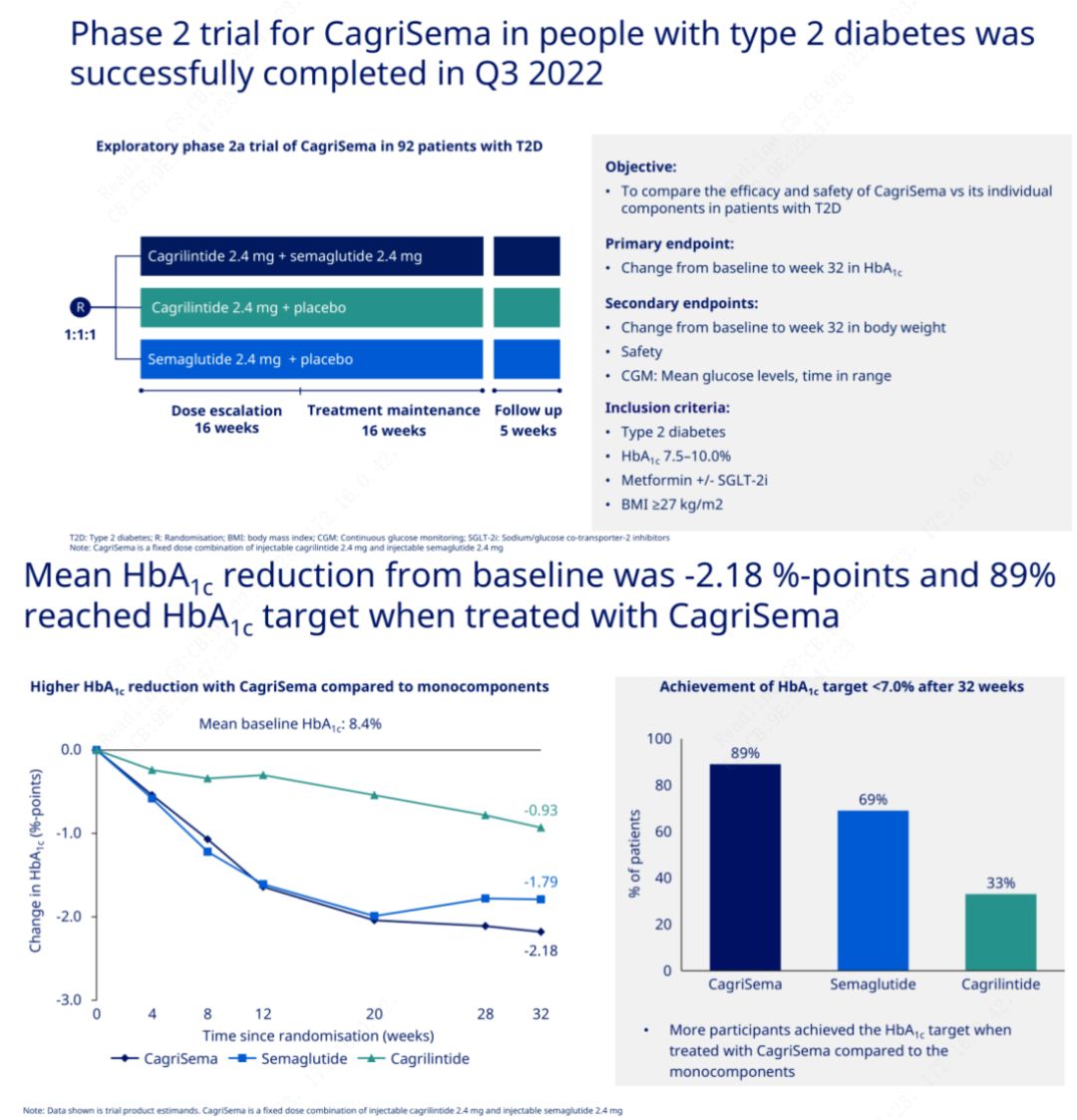
Dane wykazały, że oprócz znaczącego działania hipoglikemizującego, pod względem utraty masy ciała, wstrzyknięcie CagriSema znacznie przewyższało semeglutyd (5,1%) i cagrilintyd (8,1%), przy utracie masy ciała o 15,6%.
Innowacyjny lek Tirzepatide jest pierwszym na świecie zatwierdzonym cotygodniowym agonistą receptora GIP/GLP-1.Łączy działanie dwóch inkretyn w jedną cząsteczkę wstrzykiwaną raz w tygodniu i stanowi nową klasę leków na cukrzycę typu 2.Tyrzepatid został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków (FDA) w maju 2022 r. w celu poprawy kontroli glikemii (na podstawie diety i ćwiczeń fizycznych) u dorosłych chorych na cukrzycę typu 2, a obecnie jest zatwierdzony w Unii Europejskiej, Japonii i innych krajach.
5 lipca firma Eli Lilly ogłosiła rozpoczęcie badania III fazy SURPASS-CN-MONO dotyczącego platformy do rejestracji badań klinicznych leków i udostępniania informacji dotyczących leczenia pacjentów z cukrzycą typu 2.SURPASS-CN-MONO to randomizowane, podwójnie ślepe, kontrolowane placebo badanie III fazy, mające na celu ocenę skuteczności i bezpieczeństwa monoterapii tyrzepatidem w porównaniu z placebo u osób chorych na cukrzycę typu 2.Do badania planowano włączyć 200 pacjentów z cukrzycą typu 2, którzy nie przyjmowali żadnych leków przeciwcukrzycowych w ciągu 90 dni przed pierwszą wizytą (z wyjątkiem pewnych sytuacji klinicznych, takich jak ostra choroba, hospitalizacja lub planowy zabieg chirurgiczny, krótkotrwały (≤14 dni) stosowanie insuliny).
Oczekuje się, że cukrzyca typu 2 zostanie zatwierdzona w tym roku
W zeszłym miesiącu wyniki badania SURPASS-AP-Combo opublikowano 25 maja w przebojowym czasopiśmie Nature Medicine.Wyniki wykazały, że w porównaniu z insuliną glargine, Tirzepatide wykazał lepszą redukcję HbA1c i masy ciała w populacji pacjentów z cukrzycą typu 2 w regionie Azji i Pacyfiku (głównie Chiny): redukcja HbA1c do 2,49% i redukcja masy ciała do 7,2 kg (9,4%) po 40 tygodniach leczenia, znaczna poprawa stężenia lipidów i ciśnienia krwi, a także ogólne bezpieczeństwo i tolerancja były dobre.
Badanie kliniczne III fazy preparatu SURPASS-AP-Combo jest pierwszym badaniem leku Tirzepatide przeprowadzonym głównie z udziałem chińskich pacjentów z cukrzycą typu 2, kierowanym przez profesora Ji Linonga ze Szpitala Ludowego Uniwersytetu Pekińskiego.SURPASS-AP-Combo jest zgodne z wynikami światowej serii badań SURPASS, co dodatkowo potwierdza, że patofizjologia cukrzycy u pacjentów chińskich jest zgodna z patofizjologią pacjentów na całym świecie, co stanowi podstawę do jednoczesnych badań i rozwoju nowych leków w Chinach i na świecie, a także dostarcza solidnych dowodów potwierdzających umożliwienie chińskim pacjentom możliwie najszybszego wykorzystania najnowszych leków do leczenia cukrzycy i ich zastosowania klinicznego w Chinach.
Czas publikacji: 18 września 2023 r

